在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol•L-1,c(OH-)=10-b mol
来源:学生作业帮 编辑:搜狗做题网作业帮 分类:化学作业 时间:2024/05/05 23:38:39
在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:

(1)最初混合酸溶液中c(H2SO4)=______,c(HCl)=______;
(2)A点pH=______;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)

(1)最初混合酸溶液中c(H2SO4)=______,c(HCl)=______;
(2)A点pH=______;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)
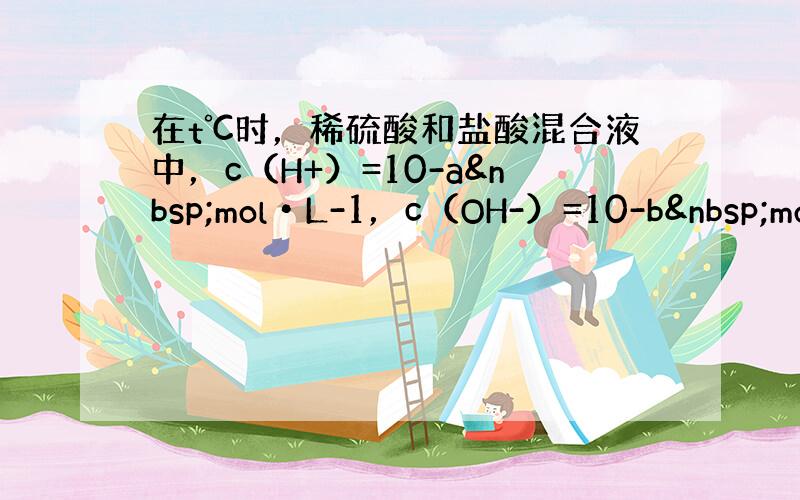
(1)该温度下,Kw=10-a×10-b=10-(a+b)=10-12,pH=11的Ba(OH)2溶液中c(OH-)=
10−12
10−11mol/L=0.1mol/L,c(Ba2+)=
1
2c(OH-)=0.05mol/L,
加入20mLBa(OH)2溶液时,沉淀量达最大,钡离子与硫酸根离子恰好反应,该阶段消耗的n(Ba2+)=0.02L×0.05mol/L=0.001mol,由离子守恒可知n(H2SO4)=n(BaSO4)=0.001mol,
故原溶液中c(H2SO4)=
0.001mol
0.02mol=0.05mol/L;
加入60mLBa(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,故混合溶液中n(H+)=n(OH-)=0.06L×0.1mol/L=0.006mol,溶液中n(HCl)=0.006mol-2×0.001mol=0.004mol,
故原混合溶液中c(HCl)=
0.004mol
0.02L=0.2mol/L,
故答案为:0.05mol/L;0.2mol/L;
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,溶液中的HCl没有反应,溶液总体积为40mL,此时溶液中H+浓度为
0.004mol
0.04L=0.1mol/L,故pH=-lg0.1=1,
故答案为:1;
(3)B点加入的氢氧化钡溶液中氢氧根离子物质的量为0.04L×0.1mol/L=0.004mol,故参加反应的氢离子为=0.004mol,溶液中剩余氢离子为0.006mol-0.004=0.002,氢离子浓度为
0.002mol
0.06L=
1
30mol/L,此时溶液pH=-lg
1
30=1.48,原混合溶液中氢离子浓度为
0.006mol
0.02L=0.3mol/L,pH=-lg0.3=0.52,故B点比最初混合酸的pH增加1.48-0.52=0.96,
答:B点比最初混合酸的pH增加0.96.
10−12
10−11mol/L=0.1mol/L,c(Ba2+)=
1
2c(OH-)=0.05mol/L,
加入20mLBa(OH)2溶液时,沉淀量达最大,钡离子与硫酸根离子恰好反应,该阶段消耗的n(Ba2+)=0.02L×0.05mol/L=0.001mol,由离子守恒可知n(H2SO4)=n(BaSO4)=0.001mol,
故原溶液中c(H2SO4)=
0.001mol
0.02mol=0.05mol/L;
加入60mLBa(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,故混合溶液中n(H+)=n(OH-)=0.06L×0.1mol/L=0.006mol,溶液中n(HCl)=0.006mol-2×0.001mol=0.004mol,
故原混合溶液中c(HCl)=
0.004mol
0.02L=0.2mol/L,
故答案为:0.05mol/L;0.2mol/L;
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,溶液中的HCl没有反应,溶液总体积为40mL,此时溶液中H+浓度为
0.004mol
0.04L=0.1mol/L,故pH=-lg0.1=1,
故答案为:1;
(3)B点加入的氢氧化钡溶液中氢氧根离子物质的量为0.04L×0.1mol/L=0.004mol,故参加反应的氢离子为=0.004mol,溶液中剩余氢离子为0.006mol-0.004=0.002,氢离子浓度为
0.002mol
0.06L=
1
30mol/L,此时溶液pH=-lg
1
30=1.48,原混合溶液中氢离子浓度为
0.006mol
0.02L=0.3mol/L,pH=-lg0.3=0.52,故B点比最初混合酸的pH增加1.48-0.52=0.96,
答:B点比最初混合酸的pH增加0.96.
在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol•L-1,c(OH-)=10-b mol
在T ℃时,某NaOH稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
温度t℃时,某NaOH稀溶液中c(H + )=10 -a mol·L -1 ,c(OH - )=10 -b mol·L
常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,
在某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol/L
某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图
关于盐酸、硫酸、醋酸有浓度均为0.1mol/L的盐酸、硫酸、醋酸; 诺三种溶液c(H+)依次为a、b、c mol/L ,
在盐酸和硫酸的混合溶液中,已知c(H+)=0.3mol/L,c(Cl-)=0.1mol/L,则SO42-的物质的量浓度为
某温度下,纯水的c(H+)=2.0×10-7 mol/L,则此时c(OH-)为______,KW=______
25℃时,0.1mol/L氨水溶液中c(H+)c(OH−)=1×10-8,下列叙述正确的是( )
0.002mol/LCa(OH)2溶液中c(Ca2+)=?mol/L .c(H+)=?mol/L .c(OH-)=?mo